1.1.3 Energía Interna y Entalpía
Energía Interna
La magnitud que designa la energía almacenada por un sistema de partículas se denomina energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular debida a las fuerzas de tipo gravitatorio, electromagnético y nuclear.
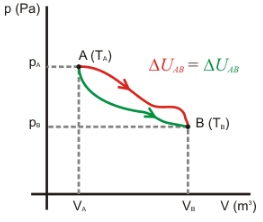
La energía interna es una función de estado, es decir, sólo depende del estado inicial y del estado final.
Como consecuencia de ello, la variación de energía interna en un ciclo es siempre nula, ya que el estado inicial y el final coinciden:
El calor intercambiado en un proceso viene dado por:
Siendo C la capacidad calorífica. En este proceso, por realizarse a volumen constante, se usará el valor Cv (capacidad calorífica a volumen constante). Entonces, se obtiene finalmente:
ENTALPÍA
La entalpía es una propiedad creada que agrupa todas las formas de energía disponibles en una sustancia que fluye. En su forma más simple la entalpía se define como la suma de la energía interna y la energía de flujo así:
∆H = U + p∆V
Dónde:
• H es la entalpía (en Joules).
• U es la energía interna (en Joules).
• p es la presión del sistema (en Pascales).
• V es el volumen del sistema (en metros cúbicos).
La energía transferida en forma de calor por un sistema durante un proceso que ocurre a presión constante es igual al cambio en la entalpía del sistema.
La entalpía es una propiedad de estado de un sistema, con lo cual se puede decir que el sistema tiene un determinado valor de entalpía. Cuando el sistema cambia de un estado inicial a un estado final, cambian las propiedades de estado.
El cambio en la entalpía, como es una propiedad de estado, depende tan sólo de las condiciones iniciales y finales, es decir, es la diferencia entre la cantidad inicial y la final,
∆H = Hfinal - Hinicial
En una reacción, se puede escribir el cambio en la entalpía como
∆H = Hproductos - Hreactivos
Las características de la entalpía:
a. Es una propiedad extensiva, es decir, es directamente proporcional a la cantidad de reactivo consumido en el proceso.
b. El cambio de entalpía para una reacción tiene la misma magnitud pero signo opuesto para la reacción inversa.
c. El cambio de entalpía para una reacción depende del estado de agregación de los reactivos y de los productos.
Ejemplo de muestra
1.
La hidracina reacciona con el cloro de acuerdo a la siguiente reacción:
N2H4 (l) Cl2 (g) → 4HCl (g) N2 (g)
∆H= 420 kJ
a) Calcular el cambio en la entalpía cuando 10 g de hidracina reaccionan con un exceso de cloro.
b) Calcular el cambio en la entalpía cuando se generan 1.5 moles de HCl(g)
Para resolver el primer inciso, primero se calcula la cantidad de moles que hay en 10 g de hidracina. La masa molar de la hidracina es 32 g/mol. Con lo cual:
10 g de hidracina = 1 mol de hidracina 32g de hidracina = 0.31 moles de hidracina
Con saber que el cambio en la entalpía de 420 kJ corresponde a un mol de hidracina, se puede calcular el cambio de entalpía asociado con 0.31 moles como se observa
H = 0.31 moles de hidracina -420 kj 1 mol de hidracina = -130.2 kJ
Para resolver el segundo inciso es necesario utilizar los coeficientes estequiométricos. El cambio en la entalpía es 420 kJ cuando se producen 4 moles de HCl (coeficiente estequiométrico igual a 4). Ahora se generan 1.5 moles, con lo cual el cambio en la entalpía es
H = 1.5 moles de HCI -420 kj4 moles HCl = -157.5 kJ
Observa que en los 2 casos el valor de H es negativo, porque la dirección de la reacción no se ha visto modificada. En todos los casos, las reacciones son exotérmicas.
Autores:
Paredes Crisanto Daniela y
Portillo Arreguin Diego Horacio
El cambio estándar de entalpia para la reacción
CaCO3 (s) ------- CaO (s)+ CO2 (g)
Es 178.1 KJ/mol. A partir de los valores de los calores estándar de formación dados en la tabla. Calcule el calor estándar de formación de CaCO3 (s)
Solución:
El cambio estándar de la entalpia en la reacción es
ΔHo = [∆HFO(CaCO)+ ∆HFO (CO2)] - ∆HFOCaCO3)
Substituyendo los valores conocidos, tenemos:
178.1kJ/mol = -635.5 kJ – 393.5 kJ - ∆HFO(CaCO3)
Al resolver para ∆HFO (CaCO3) tenemos
∆HFO (CaCO3) = -1207.1 kJ/mol
Autores:
Paredes Crisanto Daniela y
Portillo Arreguin Diego Horacio

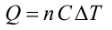






Comentarios
Publicar un comentario