1.1.8 Energía libre y espontaneidad
Procesos Espontáneos
Un proceso espontáneo puede
ocurrir rápida o lentamente.
Un ejemplo es el proceso que lleva al carbono en forma de diamante al grafito.
ser exotérmicos o endotérmicos.
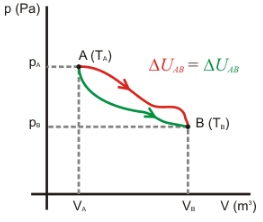
La espontaneidad de un proceso
no está necesariamente relacionada con el cambio de entalpía ΔH.
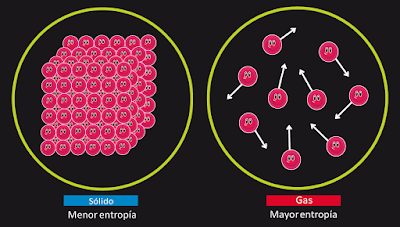
Así que todo lo que tenemos que hacer es medir el cambio de entropía del universo entero.
Por suerte, los químicos pueden
evitar tener que determinar el cambio de entropía del universo al definir y usar una nueva cantidad termodinámica que se llama
la energía libre de Gibbs.
Energía Libre
Cuando se produce un proceso a temperatura T y presión P constantes, podemos definir una nueva cantidad que se conoce como energía libre de Gibbs:
Energía libre de Gibbs= G = H –TS
En donde H es la entalpía, T es la temperatura (en kelvin, K) y S es la entropía. La energía libre de Gibbs se representa con el símbolo G, y normalmente tiene unidades de kJ/mol-reacc.
Para un proceso a T y P constantes, podemos reescribir la ecuación para la energía libre de Gibbs en función de cambios en
la entalpía ΔH.
ΔG=ΔH−TΔS
Esta ecuación es muy útil pues nos permite determinar el cambio de energía libre de Gibbs a partir del cambio de entalpía ΔH, y de entropía ΔS del sistema.
Podemos usar el signo de ΔG, para averiguar si una reacción es espontánea en un sentido o en el otro o si la reacción está en equilibrio.
- Cuando ΔG<0, el proceso es exergónico y ocurriráespontáneamente en sentido directo para formar más productos.
- Cuando ΔG>0, el proceso es endergónico y no es espontáneo en el sentido directo. Por el contrario, ocurrirá espontáneamente en el sentido inverso para producir más reactivos.
Autores:
Argüelles Braulio Eduardo
Barrios Hernández David







Comentarios
Publicar un comentario