1.1.4 Reacciones exotérmicas y endotérmicas
Reacciones Exotermicas
El prefijo exo significa “hacia fuera”. Por lo tanto entendemos que las reacciones exotérmicas son aquellas que liberan energía en forma de calor. El esquema general de una reacción exotérmica puede ser escrito de la manera siguiente, donde A, B, C y D representan sustancias genéricas.
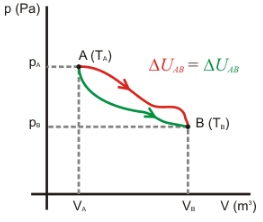
En otras palabras, toda la energía que entró en el primer miembro de la ecuación química, debe salir íntegramente en el segundo miembro de la ecuación. De donde obtenemos la siguiente conclusión: si una reacción es exotérmica, entonces la entalpía de los reactivos (Hr ) es mayor que la entalpía de los productos(Hp ), pues una parte de la energía que estaba contenida en los reactivos fue liberada para el medio ambiente en forma de calor y apenas otra parte de esa energía quedó contenida en los productos. Entonces en una reacción exotérmica: Hr > Hp
No es posible determinar directamente la entalpía de cada sustancia participante de una reacción, pero podemos determinar experimentalmente la variación de entalpía ΔH, que ocurre cuando una reacción química es realizada.
Como en la reacción exotérmica Hr > Hp , entonces en este tipo de reacción el valor de ΔH será siempre negativo.
EJEMPLOS DE REACCIÓN EXOTÉRMICA
A. La respiración de los seres vivos.
B. La oxidación de los metales.
C. Proceso de combustión de la gasolina.
D. Reacciones de ácidos base.
E. Proceso de combustión de la dinamita.
F. Reacciones de hidratación.
G. Unión de dos átomos de hidrógeno.
H. La formación de agua.
I. La formación de amoniaco.
J. Proceso de condensación
Reacciones Endotermicas
El prefijo endo significa “hacia adentro”. Por lo tanto se entiende que las reacciones endotérmicas son aquellas que absorben energía en forma de calor. El esquema general de una reacción endotérmica puede ser escrito de la siguiente manera, donde A, B, C y D representan sustancias genéricas.
Una vez que la energía total se conserva del primer para el segundo miembro de cualquier reacción química, podemos afirmar que: si una reacción es endotérmica, la entalpía de los productos Hp es mayor que la entalpía de los reactivos Hr , pues una determinada cantidad de energía fue absorbida por los reactivos en forma de calor, durante la reacción, quedando contenida en los productos. Siendo que en la reacción endotérmica: Hp > Hr.
Y siendo ΔH = Hp — Hr , entonces en la reacción endotérmica el valor de ΔH será siempre positivo. Siendo que en la reacción endotérmica: ΔH > 0.
EJEMPLOS DE REACCIÓN ENDOTÉRMICA
A. Producción de ozono.
B. Fotosíntesis de las plantas.
C. Descomposición de proteínas.
D. Reacción del bicarbonato de sodio cuando se expone al calor.
E. Proceso de fusión.
F. Oxidación del mercurio.
G. Reacción yoduro de potasio + agua.
H. Reacción agua + ácido cítrico.
I. Reacción bicromato de potasio + agua.
J. Reacción oxido de bario + nitrato de amonio.







Comentarios
Publicar un comentario