1.1.1 Sistemas, estados y funciones de estados
Cuando estudiamos el intercambio de energía en los procesos que ocurren en la naturaleza, necesitamos definir conceptos como el de sistema. En las reacciones químicas, el sistema se encuentra formado por las sustancias químicas que intervienen en ellas y el entorno sería todo lo demás.
Definición de función de estado.
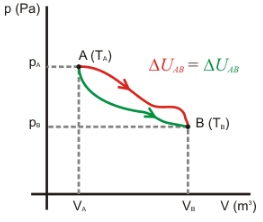
Se debe saber que algunas variables termodinámicas son, además, lo que se conoce como funciones de estado. ¿Qué significa esto? Significa que si el sistema sufre una modificación y pasa de un estado A a un estado B, el valor de estas variables termodinámicas que son funciones de estado no depende de cómo se ha efectuado la transformación, sólo del estado del sistema.
Veremos esto con un ejemplo concreto para que sea más sencillo, tomando como variable la temperatura. Consideremos un sistema que está en un estado A en el cual la temperatura es de 20ºC. Este sistema sufre una transformación y pasa a estar en un estado B en el cual la temperatura es de 60ºC. El sistema en le estado B seguirá estando a 60ºC independientemente del camino que haya seguido la transformación. No depende del camino que ha seguido dicha transformación, no importa si se ha calentado y luego enfriado, o si se ha calentado progresivamente… La temperatura en el estado B seguirá siendo de 60ºC, sin importar cómo se ha llegado a ello. Por esto, la temperatura es una función de estado, sólo depende del estado del sistema en el momento en que lo consideremos.
TIPOS DE SISTEMAS.
Existen diferentes tipos de sistemas: abiertos, cerrados y aislados.
Por un lado tenemos los sistemas abiertos, los cuales intercambian materia y energía con el entorno.
Ejemplo: en el caso de una masa de sodio que reacciona con el agua que contiene un determinado recipiente, proceso en el que se realiza un intercambio de energía, produciéndose gas hidrógeno, el cual se difunde en el entorno.
El estudio de los sistemas cerrados, resulta quizás algo más sencillo, ya que estos tipos de sistemas intercambian energía con su entorno, pero no existe un intercambio de materia.
Ejemplo: en reacciones químicas que se realizan en recipientes cerrados con un volumen constante, o a una presión constante, se dice que en dichos sistemas se impide el intercambio de materia con el entorno.
En último lugar tenemos los sistemas que no pueden ni intercambiar materia ni energía con el entorno. A estos sistemas se los conoce con el nombre de sistemas aislados.
Para saber el sistema de estado se tiene que determinar lo que se va a estudiar, para esto es necesario conocer una serie de propiedades del mismo, como pueden ser la presión, la temperatura, el volumen, su composición, etc.
Este tipo de magnitudes pueden verse alteradas, y variar a lo largo del proceso en el que el sistema pasa desde un estado inicial a un estado final. A estas magnitudes de las conoce como variables de estado, precisamente porque dichas magnitudes pueden cambiar en el transcurso de la reacción.
Todas las variables de estado no son independientes unas de otras, sino que con frecuencia se encuentran relacionadas entre sí a través de lo que se conoce como ecuaciones de estado. Por ejemplo, en el caso de un gas ideal del cual conocemos su número de moles, la presión y la temperatura, el volumen que ocupa dicho gas podremos determinarlo a través de la ecuación de estado de los gases ideales ( PV= nRT).
*P·V = n·R·T
Donde:
P = presión (atm o pascales, Pa)
V = volumen (litros o m3)
n = número de moles
R = constante de los gases ideales, 0,082 atm·l/K·mol o 8,31 J/K·mol
T = temperatura en grados kelvin (K)
Dada esta ecuación para los gases ideales, bastará conocer la presión, el volumen y la temperatura para definir el estado del sistema, y el número de moles, o la densidad, o la masa, se podrían calcular conociendo dichos valores de P, V y T. Por tanto, con estas variables el sistema quedaría totalmente descrito.
Algunas de las propiedades o de las variables que nos determinan el estado de un sistema concreto tienen un valor definido y único para cada estado del sistema. Dichas propiedades se llaman funciones de estado, y la variación de ellas sólo depende del estado inicial y final del sistema.
En los sistemas químicos (reacciones químicas), se les conoce como funciones de estado, entre otras, la presión, el volumen, la temperatura, la energía interna y la entalpía. Por el contrario, el calor y el trabajo no son funciones de estado, pues cuando un sistema sufre un proceso cíclico, se intercambia calor, y por lo tanto se desarrolla un trabajo.
Tipos de Variables termodinámicas: extensivas e intensivas
Las variables termodinámicas se clasifican en dos tipos, atendiendo a su dependencia o independencia con la cantidad total de materia presente en el sistema. Así, tenemos:
- Variables extensivas: si su valor depende de la cantidad o porción de sistema que se considera, por ejemplo: masa, volumen, número de moles…
- Variables intensivas: si su valor no depende de la cantidad de sistema considerado, por ejemplo: temperatura, densidad, presión, concentración…
En la tabla siguiente se muestran algunas variables extensivas e intensivas:


gracias , me ayudo con mi tarea :)
ResponderBorrar