1.1.6 Termoquímica. Ley de Hess.
Termoquímica. Ley de Hess.
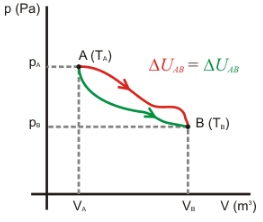
La Termoquímica estudia los cambios energéticos
ocurridos durante las reacciones químicas. El calor que se transfiere durante
una reacción química depende de la trayectoria seguida puesto que el calor no
es una función de estado. Sin embargo, generalmente las reacciones químicas se
realizan a P=cte o a V=cte, lo que simplifica su estudio. La situación más
frecuente es la de las reacciones químicas realizadas a P=cte, y en ellas el
calor transferido es el cambio de entalpía que acompaña a la reacción y se
denomina "entalpía de reacción". La entalpía es una función de
estado, luego su variación no depende de la trayectoria.
La combustión (ver figuras
8.23 y 8.24) es un ejemplo de reacciones químicas donde se liberan grandes cantidades
de energía. Por ejemplo, la combustión del hidrógeno que se indica a
continuación:
En este caso, el sistema es el hidrógeno, el
oxígeno y el agua que se forma. Los alrededores son el resto del Universo. Como
la energía no se destruye ni se crea, toda la energía liberada por el sistema
la ganan los alrededores. De esta forma, la energía se transfiere en forma de
calor del sistema hacia los alrededores. A este tipo de procesos se les conoce
como exotermicos.
Otro tipo de reacciones, como la de
descomposición del óxido de mercurio, requieren de energía para llevarse a
cabo. Esto se representa de la siguiente forma:
En esta reacción, el sistema está formado por
el óxido de mercurio, el mercurio y el oxígeno. Los alrededores son el resto
del Universo. La energía se transfiere en forma de calor en este caso de los
alrededores hacia el sistema. Si al sistema no se le da energía, la reacción de
descomposición del óxido de mercurio no se lleva a cabo. A este tipo de
procesos se les llama endotérmicos.
En un proceso endotérmico, la energía se
transfiere en forma de calor desde los alrededores hacia el sistema.
*En
una reacción exotérmica, la energía que pierde el sistema la ganan los
alrededores. En una reacción
endotérmica, la energía que gana el sistema es la que perdieron los
alrededores.
Ley de Hess
"En una reacción
química expresada como la suma (o diferencia) algebraica de otras reacciones
químicas, puesto que es función de estado, la entalpía de reacción global es
también la suma (ó diferencia) algebraica de las entalpías de las otras
reacciones."
Ley
anunciada en 1840 por el químico suizo German Henry Hess. Esta Ley también puede
llamarse Ley de aditividad de las
entalpías de reacción. Se trata de un método útil cuando no es
posible calcular las entalpías de reacción a partir de las entalpías de
formación, o en reacciones en las que la entalpía de reacción no se puede
determinar experimentalmente por ser ésta muy lenta o muy explosiva.
Para
llegar al fundamento de la Ley
de Hess, vamos a considerar un ejemplo antes de enunciarla. Se
trata de la reacción de formación de CO2(g):
Esta reacción se puede producir tal y
como la hemos escrito, en una sola etapa, o también puede darse en dos etapas.
En una primera etapa se formaría monóxido de carbono, CO, y después, una vez
formado el monóxido de carbono, éste vuelve a reaccionar con oxígeno para dar
CO2. Las etapas son:
La energía total desprendida en la
formación de 1 mol de CO2 es la misma tanto si se da en una etapa como en dos,
ya que para determinar la energía total desprendida cuando se da en dos etapas
basta sumar las variaciones de entalpía de las etapas en las que transcurre.
ΔH1 = ΔH2 + ΔH3
-393,5 = -110,4 + (-283,1)
Esta es
la base de la Ley
de Hess, que la variación de entalpía asociada a una reacción
química efectuada a presión constante es la misma si se verifica directamente
en una sola etapa o en varias. De forma general:
Otra forma de enunciarla:
Cuando dos o más ecuaciones
químicas se suman o restan, para dar una nueva ecuación química, entonces
sumando o restando los cambios en la entalpía en operaciones paralelas podemos
calcular el cambio en la entalpía de la reacción representada por la nueva
ecuación. A esto se le conoce como La ley de Hess.
Autores:
Autores:
Ortega López Sebastián Basilio
Ramos Lugo Oscar Iván
Bibliografía:


Comentarios
Publicar un comentario