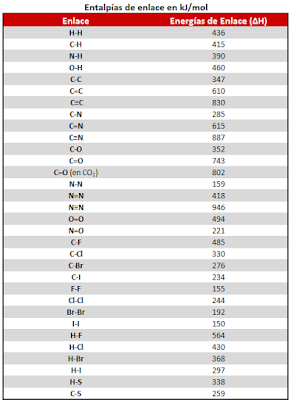
1.1.5 Entalpías de enlace.
Entalpías de enlace.
Entalpías de enlace.
La energía de enlace
Es la energía necesaria para romper un mol de enlaces en estado gaseoso.
La energía del
enlace H-H es mayor que la del enlace Cl-Cl. Esto quiere decir que el enlace en
la molécula H2, es más fuerte que en la de Cl2. Las
energías de enlace son siempre
positivas, ya que para romper un enlace se requiere energía. El concepto de
energías de enlace ayuda a comprender porque algunas reacciones son exotérmicas
y otras endotérmicas.
Si los enlaces en
las moléculas de los productos son más fuertes que en el reactivo, los
productos son más estables y tienen una energía más baja que la de los
reactivos y por lo tanto la reacción es exotérmica.
Mediante el
conocimiento de los valores de la energía de enlace se pueden calcular los ∆H de las reacciones si se consideran los
enlaces que se rompen y los que se forman durante la reacción química.
Los enlaces químicos se
forman porque son termodinámicamente favorables, y para romperlos es inevitable
agregar energía. Por esta razón, los valores de entalpía de enlace siempre son
positivos, y suelen tener unidades de kJ/mol, kcal/mol. Cuanto mayor sea la
entalpía de enlace, éste es más fuerte y más energía se necesita para romperlo.
Para determinar cuánta energía se liberará cuando, en lugar de romperse, se
forme un nuevo enlace, simplemente hacemos negativo el valor de la entalpía de
enlace.
Puesto que los valores de
entalpía de enlace son tan útiles, las entalpías de enlace promedio para tipos
de enlace comunes están disponibles en tablas de referencia. En tanto que el
cambio exacto de energía que se produce cuando se forman y rompen enlaces
depende de los átomos vecinos en una molécula específica, los valores promedio
listados en las tablas pueden utilizarse a manera de aproximación.
El uso de las entalpías de
enlace para calcular la entalpía de reacción
Una vez que entendemos lo que es la entalpía de enlace, la usamos para estimar la entalpía de reacción:
Paso 1. En los reactivos identifica
cuáles enlaces se romperán y sus entalpías de enlace.
Paso 2. Suma los valores de
entalpía de enlace para los enlaces rotos.
Paso 3. Identifica qué nuevos
enlaces se forman en los productos y haz una lista de sus entalpías de enlace
negativas. Recuerda que tenemos que cambiar el signo de los valores de entalpia
para encontrar la energía
liberada cuando se forman los enlaces.
Paso 4. Suma los valores de
entalpía de enlace para los enlaces formados del producto.
Paso 5. Combina los valores totales
para los enlaces rotos (del Paso 2) y enlaces de formación (del Paso 4) para
obtener la entalpía de reacción.
AUTORES: Vazquez Venegas Rafael y Medina Coeto Mitzi Fernanda.


Comentarios
Publicar un comentario