1.1.7 Entropía
1.1.7 ENTROPÍA
El término entropía se puede utilizar en Física, Química, Psicología, de forma filosófica, en las
Empresas, etc. Lógicamente la entropía que nosotros estudiaremos es aquella relacionada con la
física y la química.
¿Qué es la Entropía?
La entropía es una propiedad de estado en la que importa solamente el estado inicial y final, independientemente de camino recorrido para pasar de uno a otro. La entropía no se define en valores absolutos, se miden cambios (incrementos= Δ) entre uno y otro estado entrópico. Pongamos algún ejemplo para que te queda mucho más claro. Primero un sistema reversible y luego un sistema irreversible (no puede volver al estadoinicial).Ejemplos de Entropía
Tenemos una habitación ordenada =
Sistema Inicial. Ahora la desordenamos, tiramos la ropa, muebles, etc. Hemos cambiado el sistema
inicial y ahora tengo un sistema final = habitación desordenada.
Si quieres colocar las cosas para que esté la habitación ordenada te costará más o menos trabajo,
en función de lo desordenada que acabara la habitación. Más desordenada implica que necesito
más trabajo para volver a ordenarla (volver al sistema inicial).
La habitación al principio tenía muy poco entropía, ya que estaba bastante ordenada, pero
después del proceso (desordenarla) aumentó la entropía.
Cuanto más he variado el sistema inicial (habitación ordenada), más trabajo me costará volver al
estado inicial, más entropía tengo en mi habitación o más desorden. No solo es más difícil volver al
estado inicial cuanto más lo cambio, sino que además tendremos menos posibilidades de volver el
sistema (habitación) al estado inicial.
Incluso pudiera ser que nunca lograra volver al estado inicial, la habitación igual de ordenada que
al principio, esto ocurre en los sistemas llamados Irreversibles
Los estados irreversibles aumentan la entropía. Los estados que hemos cambiado mucho, tienen
mucha entropía.
Variación pequeña del estado inicial = poco entropía tenemos en el estado final.
Variación muy grande del estado inicial = gran entropía tenemos en el estado final.
Si un sistema experimenta un gran aumento de la entropía en el proceso de cambio, el sistema se
vuelve irreversible.
Un ejemplo de Sistema Irreversible. Rompemos un plato, el plato roto tendrá una gran entropía
porque es irreversible, ya no podremos dejarlo como estaba al principio. Del plato nuevo al roto se
experimenta un gran aumento de la entropía. Freír un huevo es otro proceso irreversible.
Hay una ley fundamental de la Naturaleza que dice que en todo proceso natural la entropía crece.
Por lo tanto, la entropía, se trata de una cantidad que no decrece en ningún proceso físico, y que
por lo general crece, dando lugar a procesos que reciben el nombre de irreversibles, porque no se
pueden deshacer, no es posible volver al estado de entropía anterior, dado que ésta no puede
decrecer.
Veamos un ejemplo más físico y real de un sistema irreversible. Si echamos una gota de tinta en
agua observamos cómo ésta se difunde hasta que toda el agua se vuelve de color uniforme. Lo que
jamás veremos es que las partículas de tinta se reúnan de nuevo en una gota separada del agua. Al
cambiar el sistema inicial echando la gota de tinta, hemos aumentado tanto la entropía del
sistema, que se vuelve irreversible.
Entonces.... ¿Cómo medimos la entropía? La manera de utilizarla es medirla en nuestro sistema
inicial, es decir, antes de cambiar el sistema, y volverla a medir al final del proceso que sufrió el
sistema.
Es importante señalar que la entropía no está definida como una cantidad absoluta S (símbolo de
la entropía), sino lo que se puede medir es la diferencia entre la entropía inicial de un sistema Si y
la entropía final del mismo Sf.
Es por eso que la fórmula de la entropía sería: ΔS= incremento de entropía = Sf - Si.
No tiene sentido hablar de entropía sino en términos de un cambio en las condiciones de un
sistema.
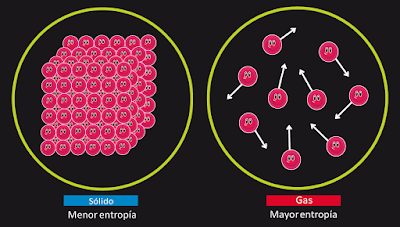
La Entropía en la Química
Si hablamos de la entropía en química, podríamos decir que es el desorden que tienen las
moléculas en un sistema. Un ejemplo:
¿Qué estado tiene más Entropía? Pues lógicamente el gas, porque tiene sus moléculas más
desordenadas. Además si calentamos el gas, sabemos que las moléculas adquieren mayor
velocidad, están más desordenadas, o lo que es lo mismo al aumentar la temperatura
aumentamos la entropía.
Otro ejemplo: Imagina un bote de perfume y pulverizamos sobre una esquina de una habitación.
El perfume no sólo permanecerá en ese rincón de la habitación. Las moléculas de perfume
acabarán llenando la habitación. El perfume pasó de un estado ordenado a un estado de
desorden, extendiéndose por toda la habitación y aumentando su entropía.
Por: Marín Gómez Camila Itzel



Comentarios
Publicar un comentario