1.2.1 Reacciones de Oxidación y Reducción.
Reacciones de oxidación y reducción.
Se considera como
reacción de transferencia de electrones La oxidación y reducción, también
conocida como redox, es un proceso
químico en el cual cambia en número de oxidación de un elemento. El proceso
puede incluir la transferencia completa de electrones para formar uniones
iónicas o sólo una transferencia parcial o desplazamiento de electrones para
formar uniones covalentes.
Se
efectúa una oxidación cuando aumenta
el número de oxidación como resultado de la pérdida de electrones. Y una reducción siempre que el número de
oxidación disminuya como resultado de
una ganancia de electrones. La oxidación y la reducción se efectúan
simultáneamente en una reacción química; una no puede sucede sin la otra.
|
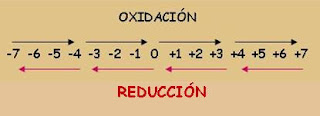
Oxidación:
Incremento del número de oxidación
Perdida de electrones.
Reducción:
Disminución del número de oxidación
Ganancia de electrones. |
El agente oxidante
se reduce y gana electrones. El agente reductor se oxida y pierde electrones.
La transferencia de electrones es característica de todas las reacciones redox.
2H(2) + O(2) à 2H(2)O
Ambos reactivos,
hidrogeno y oxigeno, son elementos en estado libre y tienen un número de
oxidación de cero. En el producto (agua), el hidrogeno se ha oxidado a +1 y el
oxigeno reducido a -2. La sustancia que causa un incremento del estado de
oxidación de otra sustancia se llama agente
oxidante. La sustancia que causa una disminución del estado de oxidación de
otra sustancia se llama agente reductor.
En esta reacción, el agente oxidante es el oxígeno libre, y el reductor, el
hidrogeno libre.
Números de oxidación
Es el número de
cargas que tendría un átomo en una molécula o un compuesto iónico, si los
electrones fueran transferidos completamente. Si en una reaccion el numero de carga varia se oxida o reduce de acuerdo a esos valores.
Características principales:
1- Elementos
libres, sin nada combinado, su número de oxidación es 0
2- En
iones de solo un átomo el número de oxidación es igual a la carga del ion
3- El
número de oxidación del oxígeno es de -2 menos en H2O2 Y O2
que es -1 y del hidrogeno +1 menos en compuestos binarios, ahí es -1.
4- Pueden
no ser enteros
5- La suma
debe ser 0 en una molécula neutra.
6- Fluor
su número de oxidación es -1
AUTORES:
Vazquez Venegas Rafael y
Medina Coeto Mitzi Fernanda.
Vazquez Venegas Rafael y
Medina Coeto Mitzi Fernanda.


Comentarios
Publicar un comentario